近日,生命科学研究院新靶标与化学干预研究中心刘俊彦教授作为共同通讯作者,在国际著名学术期刊《CancerResearch》发表题为“Fusobacterium NucleatumPromotes the Development of Colorectal Cancer by Activating a Cytochrome P450/Epoxyoctadecenoic Acid Axis via LR4/Keap1/NRF2 Signaling”的研究论文,揭示肠道微生物具核梭杆菌(Fusobacteriumnucleatum,Fn)促进结直肠癌肿瘤转移的新机制。

结直肠癌是全球常见的癌症之一,在全球男性确诊肿瘤病例中排第三,在全球女性确诊肿瘤病例中排第二。2020年全球有近115万新发病例,近58万病人死于结直肠癌。近来发现肠道微生物Fn可促进结直肠癌的发生、发展和转移,但是其作用机制尚有许多未名之处。本研究利用代谢组学、微生物组学、和宏基因组学技术,综合分析临床样本、动物模型、和细胞模型,发现具核梭杆菌可通过激活细胞色素P450(CYP),主要是CYP2J2,及其调控的代谢产物环氧十八碳烯酸(EpOME),促进结直肠癌转移。而Fn上调CYP2J2的机制与其激活TLR4/Keap/NRF2通路相关。
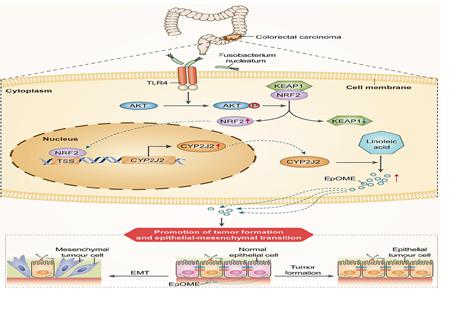
本研究首先利用靶向代谢组学技术发现在临床结直肠患者和结直肠癌小鼠中EpOMEs显著升高,继而揭示EpOMEs的增高系由其合成酶CYPs,主要是CYP2J2增高所致;然后利用细胞模型和动物模型研究发现EpOMEs以及上调CYP2J2均可促进结直肠癌转移;然后利用微生物组学临床样本中发现结直肠癌患者中Fn等肠道微生物显著增高,而Fn和EpOME以及CYP2J均具有显著相关性;进而利用细胞模型和无菌小鼠结合基因敲除小鼠模型发现Fn可上调CYP2J2/EpOME轴促进结直肠癌转移;最后利用宏基因组学研究发现Fn通过激活TLR4/Keap/NRF2通路上调CYP2J2。本研究首次揭示了肠道微生物通过调控代谢通路/代谢产物促进结直肠癌转移,为Fn感染的结直肠癌患者的诊断提供了新的诊断标志物,并为这些病人的治疗提供了新的干预靶点。
刘俊彦,博士、博士研究生导师,2020年4月起任重庆医科大学生命科学研究院特聘教授,新靶标与化学干预研究中心PI。主要从事代谢组学、药理学与天然药物化学等方面的研究。已在PNAS, Cancer Research, British Journal of Pharmacology等杂志发表论文60余篇, Google Scholar 引用3900余次,h-index 33。主持国家自然科学基金、中国博士后基金、 江苏省博士后基金、上海市科委自然科学基金等项目,获教育部自然科学一等奖、NIEHS-UCD超级研究计划配套基金奖、ASPET学术年会旅行奖等。是中国药理学会肾脏药理专委会全国委员,美国药理和实验治疗协会(ASPET)会员。曾担任国家自然科学基金委通讯评议人,Frontiers in Pharmacology杂志客座编辑,Chemical Engineering Journal, Cancer Immunology Research, Signal Transduction and Targeted Therapy, Trends in Analytical Chemistry, Kidney International, Theranostics等杂志审稿人。
原文链接见https://cancerres.aacrjournals.org/content/81/17/4485。