4月8日,我校基础医学院金艾顺教授与日本富山大学医学部免疫学研究室Kishi Hiroyuki/Atsushi Muraguchi/Kobayashi Eiji等合作的研究成果在生物医学工程TOP期刊《Nature Biomedical Engineering》杂志在线发表。该成果发现了T细胞识别抗原新机制,并研发了将其应用于肿瘤特异性T细胞受体(TCR)快速筛选和TCR-T细胞免疫治疗的新技术。

机体免疫系统的免疫细胞能识别和清除体内的肿瘤细胞或被病毒感染的细胞。T淋巴细胞(T细胞)介导的细胞免疫应答反应在识别和清除病变细胞中发挥重要作用。T细胞杀伤靶细胞(肿瘤细胞或被病毒感染的细胞等)的作用机制是通过T细胞表面表达的TCR识别并结合靶细胞表面MHC分子提呈的抗原肽(MHC-抗原肽复合物),对其进行攻击和杀伤进而清除靶细胞。至今,T细胞上的TCR与靶细胞上的MHC-抗原肽相互作用而活化T细胞,我们叫做trans-activation(图1b),这种T细胞的活化机制是被发现几十年以来被公认的公理。
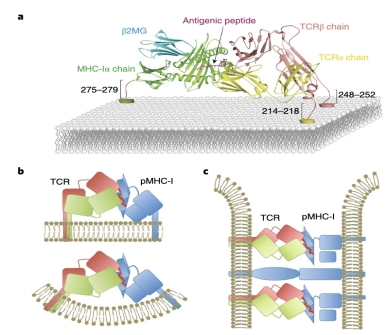
图1 TCR与同一T细胞表达的pMHC复合物结合模拟图(a)。TCR与同一T细胞上的pMHC的cis相互作用(b)。
传统的TCR与pMHC-I的trans活化机制(传统的)(c)。
通常,T细胞也通过自身表达的MHC分子提呈抗原肽。该合作团队研究发现同一个T细胞上的TCR能与这个T细胞上的MHC-抗原肽结合并被活化,并将这个新发现的活化机制叫做cis-activation(图1ab)。至今国际上尚未见有相关报道,是对T细胞活化机制的补充。
合作团队利用这个T细胞活化的新机制研发了特异性T细胞快速分析和TCR基因快速筛选技术,比此前报道的TCR-T细胞技术(Nat Med. 2013 Nov;19(11):1542-6)更加快速有效,为TCR-T细胞抗肿瘤免疫治疗提供了崭新的技术平台。通过该技术筛选的TCR制备的TCR-T细胞展现出比以往方法用于临床试验的TCR- T细胞具有更强的肿瘤杀伤作用。
该研究成果的重大意义在于:一是发现T细胞活化新机制,将为详细阐明T细胞发生发育机制提供重要科学理论依据。二是研发的TCR基因筛选技术能更有效从患者血液筛选具有杀伤性的TCR,为TCR- T细胞抗肿瘤或抗感染的免疫治疗提供技术平台。
基础医学院免疫研究中心主任金艾顺教授是本研究主要作者之一。金艾顺教授长期致力于肿瘤免疫治疗研究,早期主要从事抗体药物研究,在全人源单克隆抗体快速筛选技术研发和抗体药物研究等方面取得突破性研究成果(Nat Med. 2009 Sep;15(9):1088-92.)。近年来,金艾顺主要聚焦于T细胞活化机制和TCR-T细胞免疫治疗方面。在T细胞活性机制研究时,受抗体技术研发的启发,金艾顺团队将T细胞用于单细胞分离独立培养,发现在添加抗原肽刺激没有靶细胞提呈MHC分子时T细胞也能被活化分泌效应因子,在经历长达10年研究和求证后提出T细胞活化新机制和新理论,该理论如果通过更先进技术得到更多更深的研究和应用,将有望为阐明自身免疫性疾病等更多疾病的发病机制提供新思路。
原文链接:https://rdcu.be/cKSAh