近日,我校附属妇女儿童医院生殖医学中心李竞宇/黄国宁团队联合温州医科大学孔庆然团队及同济大学高绍荣团队,在国际知名期刊《National Science Review》发表了题为“Lactate regulates major zygotic genome activation by H3K18 lactylation in mammals”的研究论文。该研究揭示了乳酸通过H3K18lac调控哺乳动物主要ZGA基因的重要作用,扩展了新型表观修饰在哺乳动物植入前胚胎发育过程中的重塑及功能机制,为改善人类胚胎体外培养液从而提高辅助生殖成功率奠定了理论基础。

该研究首先采用华东理工大学赵玉政教授团队研发FiLa探针技术,绘制了小鼠着床前胚胎的亚细胞乳酸代谢图谱,发现在2-细胞胚胎中乳酸主要富集于细胞核中。之前的研究表明,乳酸在受精卵和2-细胞胚胎中发生氧化,可以引起2-细胞胚胎丙酮酸的氧化下降,但从培养液中去除外源乳酸对小鼠胚胎的体外发育并没与显著影响且丙酮酸可经过LDH氧化产生内源乳酸补偿外源乳酸的缺失。据此,该研究同时去除内源(添加LDH抑制剂Gne140或GSK2837808A,同时添加NMN补偿氧化型NAD)和外源(去除培养液中乳酸)乳酸,发现乳酸缺失导致小鼠胚胎发育阻滞在2-细胞期。在转录组测序时发现乳酸缺失导致大量主要ZGA基因下调,而初级ZGA基因表达没有显著变化。同时,EU标记新生RNA的检测和Pol II的免疫荧光染色也证明了乳酸缺失导致主要ZGA基因失败。由于在小鼠2-细胞胚胎中乳酸主要富集于细胞核中,因此研究团队推测乳酸可通过建立组蛋白乳酰化修饰激活主要ZGA基因表达。通过免疫荧光筛选,该研究发现乳酸缺失导致H3K18lac修饰下降最显著。通过低样本量Cut&Tag检测,该研究建立了小鼠各时期着床前胚胎H3K18lac修饰的动态图谱,发现其在大量主要ZGA基因启动子区显著富集。为了进一步验证H3K18lac功能,该研究通过合子显微注射,过表达H3K18R突变体mRNA,发现突变体的过表达导致小鼠胚胎发育2-细胞阻滞,H3K18lac下降及主要ZGA基因激活失败。
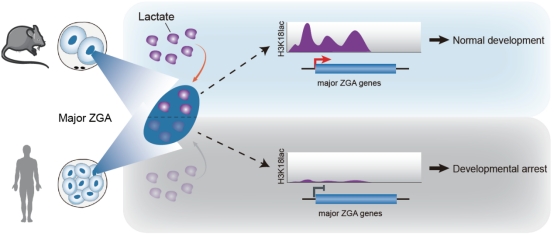
文章模式图(图源自National Science Review)
重庆医科大学附属妇女儿童医院生殖医学中心研究部副主任李竞宇,温州医科大学孔庆然实验室博士生侯卫博、瓯江实验室助理研究员赵芪及附属妇女儿童医院生殖医学中心实验技术部主任韩伟为论文的并列第一作者。同济大学生命科学与技术学院高绍荣,重庆医科大学附属妇女儿童医院生殖医学中心黄国宁,温州医科大学孔庆然为本文的共同通讯作者。附属妇女儿童医院生殖医学中心李竞宇/黄国宁课题组长期致力于代谢组与表观组互作调控哺乳动物早期胚胎发育的机制研究。2022年,附属妇女儿童医院李竞宇/黄国宁团队在《CellDiscovery》期刊上发表了早期胚胎的代谢组学研究成果,首次描绘了小鼠植入前胚胎全时期代谢动态图谱,并揭示了氧化型NAD协同SIRT1介导H3K27ac去乙酰化精准调控次要ZGA程序的功能机制。在此研究中,科研人员还发现乳酸在2-细胞胚胎中表现出高的代谢水平,暗示乳酸在ZGA过程中可能存在重要功能。
原文链接:https://academic.oup.com/nsr/advance-article/doi/10.1093/nsr/nwad295/7438878?searchresult=1